- Indicar funciones y puesto.
- Objeto del contrato.
- El trabajador declara tener los conocimientos y experiencia para desempeñar el trabajo.
- Duración de la jornada de trabajo.
- Salario y periodo de pago.
- El trabajador acepta el descuento de impuestos.
- Días de descanso.
- Obligación del trabajador de dar recibo al patrón.
- Horas extra.
- Vacaciones.
- Capacitación
- Rescisión del contrato.
- Todo lo no previsto en el contrato se resolverá de acuerdo a la LFT.
- Fecha y firma.
miércoles, 27 de agosto de 2014
Contenido de un contrato individual de trabajo.
Las Normas
Tipos de normas:
Características de las normas:
- Los usos o costumbres, también llamadas normas sociales, han surgido espontáneamente de la práctica repetida en el tiempo de ciertas conductas, basadas en el respeto mutuo, que han creado conciencia de obligatoriedad.
- Las normas morales, son impuestas por la conciencia de cada uno, basadas seguramente en la moral colectiva, que coincide en una serie de valores éticos, considerados como positivos para la convivencia y respeto de la dignidad humana.
- Las normas religiosas, son prescriptas por la comunidad religiosa a la que cada persona pertenece, y la sanción en caso de incumplimiento, es divina. Por ejemplo, si no rezas irás al infierno.
- Las normas jurídicas son aquellas que conforman el ordenamiento legal de un estado, dictadas por órganos específicos del mismo, y aplicadas también por instituciones, integradas generalmente por jueces.
Características de las normas:
- Heterónoma.- Significa que las normas o reglas son creadas por un sujeto distinto al destinatario de la norma y que además ésta le es impuesta aun en contra de su voluntad.
- Autónoma.- Porque nace o surge de acuerdo a la propia voluntad del individuo, es decir, son normas que no se encuentran previamente dictadas o creadas por algún sujeto distinto al individuo que debe cumplir con la norma.
- Externa.- Es la manifestación de nuestra voluntad, es decir, exteriorizamos nuestro proceder mediante actos o acciones.
- Interna.- Es cuando la norma regula los actos internos, interiores de cada persona, no es necesario externarlos.
- Bilateral.- Porque frente al sujeto obligado estará otro que tiene el derecho de exigir el cumplimiento de la obligación.
- Unilateral.- Frente al sujeto obligado no va a existir otra persona facultada para reclamarle la obediencia de lo establecido por la norma.
- Coercible.- Significa que en caso de inobservancia de la norma jurídica se puede hacer valer mediante la fuerza pública, aún en contra de la voluntad del sujeto.
- Incoercible.- Porque no se nos puede obligar al cumplimiento forzado de la norma.
Trastornos alimenticios.
Conjunto de síntomas entre los que prevalece una alteración o distorsión de la auto-imagen corporal, un gran temor a subir de peso y la adquisición de una serie de valores a través de una imagen corporal.
Anorexia. Trastorno alimenticio que consiste en la reducción del apetito, lo que puede llevar a que la persona comience a ingerir menos alimentos.
Bulimia. Es un trastorno alimenticio caracterizado por consumir comida en exceso en periodos de tiempo muy cortos, para después eliminar el exceso de alimento a través de vómitos o laxantes.
Obesidad. Es una enfermedad que se caracteriza por la acumulación de grasa en el cuerpo, puede tener múltiples causas, ya sean genéticas, ambientales o psicológicas.
Anorexia. Trastorno alimenticio que consiste en la reducción del apetito, lo que puede llevar a que la persona comience a ingerir menos alimentos.
Bulimia. Es un trastorno alimenticio caracterizado por consumir comida en exceso en periodos de tiempo muy cortos, para después eliminar el exceso de alimento a través de vómitos o laxantes.
Obesidad. Es una enfermedad que se caracteriza por la acumulación de grasa en el cuerpo, puede tener múltiples causas, ya sean genéticas, ambientales o psicológicas.
Cambios que se presentan en la adolescencia.
Los varones presentan:
En las mujeres se observa:
- Crecimiento de los testículos, el pene y el escroto.
- Aumento en el tamaño de la laringe.
- Ensanchamiento de hombros y crecimiento de los huesos.
- Aparición del vello axilar y púbico.
- Aumento del tamaño de los músculos.
- Cambio del tono de voz.
- Aparición de la primera eyaculación o eyarca, alrededor de los 14 años, aunque en algunos esto puede ocurrir antes de los 11 o después de los 16.
- Cambio en la textura de la piel.
- Aumento de la secreción de grasa y sudor.
- Aparición del vello facial y corporal.
En las mujeres se observa:
- Crecimiento de los pezones y coloración de las aréolas.
- Crecimiento de los senos.
- Ensanchamiento de la pelvis.
- Crecimiento del vello axilar y púbico.
- Cambios en el tejido que cubre la cavidad vaginal (mucosa).
- Crecimiento de los genitales internos y externos.
- Aparición de la primera menstruación o menarquía (generalmente a los 13 años, pero también puede tener lugar a los 9 o a los 18 años).
- Aumento de la secreción y metabolismo de la grasa.
- Cambios en el tono de la voz.
- Producción de óvulos y, con ello, la posibilidad de embarazos.
Mecanismos de transmisión de calor.
Conducción: Es la transferencia de calor que se produce a través de un medio estacionario -que puede ser un sólido- cuando existe una diferencia de temperatura.
Convección: La convección es una de las tres formas de transferencia de calor y se caracteriza porque se produce por medio de un fluido (líquido o gas) que transporta el calor entre zonas con diferentes temperaturas.
Radiación: se puede atribuir a cambios en las configuraciones electrónicas de los átomos o moléculas constitutivas. En ausencia de un medio, existe una transferencia neta de calor por radiación entre dos superficies a diferentes temperaturas, debido a que todas las superficies con temperatura finita emiten energía en forma de ondas electromagnéticas.
Convección: La convección es una de las tres formas de transferencia de calor y se caracteriza porque se produce por medio de un fluido (líquido o gas) que transporta el calor entre zonas con diferentes temperaturas.
Radiación: se puede atribuir a cambios en las configuraciones electrónicas de los átomos o moléculas constitutivas. En ausencia de un medio, existe una transferencia neta de calor por radiación entre dos superficies a diferentes temperaturas, debido a que todas las superficies con temperatura finita emiten energía en forma de ondas electromagnéticas.
Densidad.
Es una magnitud escalar referida a la cantidad de masa en un determinado volumen de una sustancia.
En el Sistema Internacional de Unidades (SI):
En el Sistema anglosajón de unidades:
Ejemplos de sustancias con diferentes densidades.
En el Sistema Internacional de Unidades (SI):
- kilogramo por metro cúbico (kg/m³).
- gramo por centímetro cúbico (g/cm³).
- kilogramo por litro (kg/L) o kilogramo por decímetro cúbico. La densidad del agua es aproximadamente 1 kg/L (1000 g/dm³ = 1 g/cm³ = 1 g/mL).
- gramo por mililitro (g/mL), que equivale a (g/cm³).
- Para los gases suele usarse el gramo por decímetro cúbico (g/dm³) o gramo por litro (g/L), con la finalidad de simplificar con la constante universal de los gases ideales:
En el Sistema anglosajón de unidades:
- onza por pulgada cúbica (oz/in³)
- libra por pulgada cúbica (lb/in³)
- libra por pie cúbico (lb/ft³)
- libra por yarda cúbica (lb/yd³)
- libra por galón (lb/gal)
- libra por bushel americano (lb/bu)
- slug por pie cúbico.
Ejercicios:
Ejemplos de sustancias con diferentes densidades.
- La densidad del acero es mayor que la del algodón, ya que un kilo de acero ocupa menos volumen que un kilo de algodón.
- La densidad del agua es mayor que la del vapor de agua, puesto que hay más moléculas en un litro de agua que en un litro de vapor.
- La densidad de población de una ciudad hace referencia al número de habitantes por kilómetro cuadrado.
Leyes de Newton.
Primera ley de Newton o ley de la inercia.
Todo cuerpo persevera en su estado de reposo o movimiento uniforme y rectilíneo a no ser que sea obligado a cambiar su estado por fuerzas impresas sobre él.
Ejemplos:
A. Si una persona empuja a otra de peso similar, las dos se mueven pero en sentido contrario.
B. Cuando brincamos empujamos a la tierra hacia abajo y ésta nos empuja con la misma intensidad hacia arriba.
C. Una persona que rema en una lancha empuja el agua con el remo en una dirección y el agua responde empujando la lancha en dirección contraria.
Segunda ley de Newton o ley de fuerza.
Ejemplos:
A. Si una persona empuja a otra de peso similar, las dos se mueven pero en sentido contrario.
B. Cuando brincamos empujamos a la tierra hacia abajo y ésta nos empuja con la misma intensidad hacia arriba.
C. Una persona que rema en una lancha empuja el agua con el remo en una dirección y el agua responde empujando la lancha en dirección contraria.
Segunda ley de Newton o ley de fuerza.
El cambio de movimiento es proporcional a la fuerza motriz impresa y ocurre según la línea recta a lo largo de la cual aquella fuerza se imprime.
F=ma
Donde:
F=Fuerza
m=Masa.
a=Aceleración
F=ma
Donde:
F=Fuerza
m=Masa.
a=Aceleración
Ejemplos:
A. Si una persona empuja a otra de peso similar, las dos se mueven pero en sentido contrario.
B. Cuando brincamos empujamos a la tierra hacia abajo y ésta nos empuja con la misma intensidad hacia arriba.
C. Una persona que rema en una lancha empuja el agua con el remo en una dirección y el agua responde empujando la lancha en dirección contraria.
Tercera ley de Newton o principio de acción y reacción.
A. Si una persona empuja a otra de peso similar, las dos se mueven pero en sentido contrario.
B. Cuando brincamos empujamos a la tierra hacia abajo y ésta nos empuja con la misma intensidad hacia arriba.
C. Una persona que rema en una lancha empuja el agua con el remo en una dirección y el agua responde empujando la lancha en dirección contraria.
Tercera ley de Newton o principio de acción y reacción.
Con toda acción ocurre siempre una reacción igual y contraria: quiere decir que las acciones mutuas de dos cuerpos siempre son iguales y dirigidas en sentido opuesto.
Ejemplos:
A. Si una persona empuja a otra de peso similar, las dos se mueven pero en sentido contrario.
B. Cuando brincamos empujamos a la tierra hacia abajo y ésta nos empuja con la misma intensidad hacia arriba.
C. Una persona que rema en una lancha empuja el agua con el remo en una dirección y el agua responde empujando la lancha en dirección contraria.
Ejemplos:
A. Si una persona empuja a otra de peso similar, las dos se mueven pero en sentido contrario.
B. Cuando brincamos empujamos a la tierra hacia abajo y ésta nos empuja con la misma intensidad hacia arriba.
C. Una persona que rema en una lancha empuja el agua con el remo en una dirección y el agua responde empujando la lancha en dirección contraria.
Ejercicios de Velocidad.
A. Un autobús recorre la distancia entre la ciudad de Cuernavaca y la Ciudad de México, que es de 820 kilómetros, en 11 horas. Calcular la velocidad promedio del autobús.
v = d/t
v = ?
d = 820 km
t = 11 horas
v = d/t = 820/11 = 74.55 km/h
B. Un automóvil avanza a 60 km/h, durante 7 horas y media. Calcular la distancia recorrida.
d = v*t
d = ?
v = 60 km/h
t = 7.5 horas
d = v*t = 60 * 7.5 = 450 km3.
C. Un corredor recorre una distancia de 14 kilómetros a una velocidad de 312 m/min. Calcular el tiempo que tardó en completar el recorrido.
t = d/v
t = ?
d = 14 km (14,000 metros)
v = 311.1 m/min
t = d/v = 14,000 / 311.1 = 45 minutos.
v = d/t
v = ?
d = 820 km
t = 11 horas
v = d/t = 820/11 = 74.55 km/h
B. Un automóvil avanza a 60 km/h, durante 7 horas y media. Calcular la distancia recorrida.
d = v*t
d = ?
v = 60 km/h
t = 7.5 horas
d = v*t = 60 * 7.5 = 450 km3.
C. Un corredor recorre una distancia de 14 kilómetros a una velocidad de 312 m/min. Calcular el tiempo que tardó en completar el recorrido.
t = d/v
t = ?
d = 14 km (14,000 metros)
v = 311.1 m/min
t = d/v = 14,000 / 311.1 = 45 minutos.
Tipos de Onda
Según su forma.
Según el medio en el que se propagan.
- Ondas longitudinales: son aquellas que se caracterizan porque las partículas del medio se mueven o vibran paralelamente a la dirección de propagación de la onda. Por ejemplo, un muelle que se comprime da lugar a una onda longitudinal.
- Ondas transversales: son aquellas que se caracterizan porque las partículas del medio vibran perpendicularmente a la dirección de propagación de la onda. Por ejemplo, las olas en el agua o las ondulaciones que se propagan por una cuerda.
Según el medio en el que se propagan.
- Ondas electromagnéticas: estas ondas no necesitan de un medio para propagarse en el espacio, lo que les permite hacerlo en el vacío a velocidad constante, ya que son producto de oscilaciones de un campo eléctrico que se relaciona con uno magnético asociado.
- Ondas mecánicas: a diferencia de las anteriores, necesitan un medio material, ya sea elástico o deformable para poder viajar. Este puede ser sólido, líquido o gaseoso y es perturbado de forma temporal aunque no se transporta a otro lugar.
- Ondas gravitacionales: estas ondas son perturbaciones que afectan la geometría espacio-temporal que viaja a través del vacío. Su velocidad es equivalente a la de la luz.
Vector.
Es una magnitud física definida por un punto del espacio donde se mide dicha magnitud, además de un módulo (o longitud), su dirección (u orientación) y su sentido (que distingue el origen del extremo).
Características:
- Dirección. Si representamos el vector gráficamente podemos diferenciar la recta soporte o dirección, sobre la que se traza el vector.
- Módulo. El módulo o amplitud con una longitud proporcional al valor del vector.
- Sentido. El sentido, indicado por la punta de flecha, siendo uno de los dos posibles sobre la recta soporte.
- Punto de aplicación. El punto de aplicación que corresponde al lugar geométrico al cual corresponde la característica vectorial representado por el vector.
- Nombre. El nombre o denominación es la letra, signo o secuencia de signos que define al vector.
Temperatura.
Es una magnitud escalar relacionada con la energía interna de un sistema termodinámico.
Las escalas de temperatura se dividen en:
Conversión de escalas de temperatura.
Las escalas de temperatura se dividen en:
- Relativas: Grado Celsius (°C), Grado Fahrenheit (°F) y Grado Réaumur (°Ré, °Re, °R).
- Absolutas: Kelvin (K)
Conversión de escalas de temperatura.
Magnitud física.
Es una propiedad o cualidad medible de un sistema físico, es decir, a la que se le pueden asignar distintos valores como resultado de una medición o una relación de medidas.
Magnitudes físicas fundamentales para el Sistema Internacional.
Magnitudes derivadas para el Sistema Internacional.
Las unidades derivadas se usan para las siguientes magnitudes: superficie, volumen, velocidad, aceleración, densidad, frecuencia, periodo, fuerza, presión, trabajo, calor, energía, potencia, carga eléctrica, diferencia de potencial, potencial eléctrico, resistencia eléctrica, etcétera. Algunas de las unidades usadas para esas magnitudes derivadas son:
Magnitudes físicas fundamentales para el Sistema Internacional.
- Longitud: metro (m). El metro es la distancia recorrida por la luz en el vacío en 1/299 792 458 segundos. Este patrón fue establecido en el año 1983.
- Tiempo: segundo (s). El segundo es la duración de 9 192 631 770 períodos de la radiación correspondiente a la transición entre los dos niveles hiperfinos del estado fundamental del cesio-133. Este patrón fue establecido en el año 1967.
- Masa: kilogramo (kg). El kilogramo es la masa de un cilindro de aleación de Platino-Iridio depositado en la Oficina Internacional de Pesas y Medidas. Este patrón fue establecido en el año 1887.
- Intensidad de corriente eléctrica: amperio (A). El amperio o ampere es la intensidad de una corriente constante que, manteniéndose en dos conductores paralelos, rectilíneos, de longitud infinita, de sección circular despreciable y situados a una distancia de un metro uno de otro, en el vacío, produciría una fuerza igual a 2×10−7 newton por metro de longitud.
- Temperatura: kelvin (K). El kelvin es la fracción 1/273,16 de la temperatura del punto triple del agua.
- Cantidad de sustancia: mol (mol). El mol es la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos hay en 12 gramos de carbono-12.
- Intensidad luminosa: candela (cd). La candela es la unidad luminosa, en una dirección dada, de una fuente que emite una radiación monocromática de frecuencia 540×1012 Hz y cuya intensidad energética en dicha dirección es 1/683 vatios por estereorradián.
Magnitudes derivadas para el Sistema Internacional.
Las unidades derivadas se usan para las siguientes magnitudes: superficie, volumen, velocidad, aceleración, densidad, frecuencia, periodo, fuerza, presión, trabajo, calor, energía, potencia, carga eléctrica, diferencia de potencial, potencial eléctrico, resistencia eléctrica, etcétera. Algunas de las unidades usadas para esas magnitudes derivadas son:
- Fuerza: newton (N) que es igual a kg·m/s²
- Energía: julio (J) que es igual a kg·m²/s²
Ejercicios sobre Masa Atómica.
1. El cloro tiene dos isótopos: Cl-35 en un 75,5 % y Cl-37 en un 24,5 %. Por tanto, la masa atómica media será:
M.a.= (35 x 0.755) + (37 x 0.245) = 35.49 uma.
2. El neón tiene 2 isótopos: uno de masa atómica 20 uma y abundancia del 90 % y otro de masa atómica 22 uma y abundancia del 10 %. ¿Cuál es la masa atómica media ponderada del neón?
M.a.= (20 x 0.9) + (22 x 0.1) = 20.2
3. El magnesio tiene 3 isótopos: uno de masa atómica 24 uma y abundancia del 78.7 %, otro de masa atómica 25 uma y abundancia del 10.13 % y otro de masa atómica 26 uma y abundancia 11.17 %. ¿Cuál es la masa atómica media ponderada del magnesio?
M.a.= (24 x 0.787) + (25 x 0.103) + (26 x 0.1117) = 24.32 uma.
4. El estroncio, tal como existe en estado natural, está compuesto de cuatro isótopos que se enumeran a continuación con sus abundancias relativas expresadas en porcentajes de átomos. Isótopos: 83.913 uma a 0.560%, 85.909 uma a 9.86%, 86.909 uma a 7.02%, 87.906 uma a 82.56%. A partir de estos datos, calcula la masa atómica del estroncio en estado natural.
M.a.= (83.913 x 0.0056) + (85.909 x 0.0986) + (86.909 x 0.0702) + (87.906 x 0.8256) = 87.6167 uma.
5. El Uranio tiene 3 isótopos: 234 uma a 0.0057%, 235 uma a 0.72% y 238 uma a 99.27%. calcula la masa atómica.
M.a.= (234 x 0.000057) + (235 x 0.0072) + (238 x 0.9927) = 237.9679 uma
6. El oxígeno tiene 3 isótopos: (99.759%) con masa atómica 15.99491 umas, (0.037%) con un masa atómica de 16.99914 umas y (0.204%) con una masa de 17.99916. ¿Cuál es la masa atómica del oxígeno?
M.a.= (15.99491 x .99759) + (16.99914 x 0.00037) + (17.99916 x 0.00204) = 15.9994
7. El cobre natural está formado por los isótopos Cu-63 y Cu-65. El más abundante es el primero, con una distribución isotópica de 64, 4 %. Calcula la masa atómica aproximada del cobre.
M.a.= (63 x 0.644) + (65 x 0.356) = 63.7120
8. El plomo tiene 4 isótopos: Pb-204, Pb-207, Pb-208 y Pb-209. La abundancia de los tres primeros es 2, 28.2 y 57.8 %. Calcula la masa atómica del Plomo.
M.a.= (204 x 0.02) + (207 x 0.282) + (208 x 0.578) + (209 x 0.12) = 207.7580
9. El litio tiene dos isótopos: 6.01512 uma a 7.42% y 7.016 uma a 92.58%, determina la masa atómica del litio.
M.a= (6.01512 x 0.0742) + (7.016 x 0.9258) = 6.9417
10. El Estaño tiene 10 isótopos: 112 uma a 0.95%, 114 uma a 0.65%, 115 uma a 0.34%, 116 uma a 14.24%, 117 uma a 7.57%, 118 uma a 24.01%, 119 uma a 8.58%, 120 uma a 32.97%, 122 uma a 4.71% y 124 uma a 5.98%. Calcula la masa atómica del Estaño.
M.a.= (112 x 0.0095) + (114 x 0.0065) + (115 x 0.0034) + (116 x 0.1424) + (117 x 0.0757) + (118 x 0.2401) + (119 x 0.0858) + (120 x 0.3297) + (122 x 0.0471) + (124 x 0.0598) = 118.8387
M.a.= (35 x 0.755) + (37 x 0.245) = 35.49 uma.
2. El neón tiene 2 isótopos: uno de masa atómica 20 uma y abundancia del 90 % y otro de masa atómica 22 uma y abundancia del 10 %. ¿Cuál es la masa atómica media ponderada del neón?
M.a.= (20 x 0.9) + (22 x 0.1) = 20.2
3. El magnesio tiene 3 isótopos: uno de masa atómica 24 uma y abundancia del 78.7 %, otro de masa atómica 25 uma y abundancia del 10.13 % y otro de masa atómica 26 uma y abundancia 11.17 %. ¿Cuál es la masa atómica media ponderada del magnesio?
M.a.= (24 x 0.787) + (25 x 0.103) + (26 x 0.1117) = 24.32 uma.
4. El estroncio, tal como existe en estado natural, está compuesto de cuatro isótopos que se enumeran a continuación con sus abundancias relativas expresadas en porcentajes de átomos. Isótopos: 83.913 uma a 0.560%, 85.909 uma a 9.86%, 86.909 uma a 7.02%, 87.906 uma a 82.56%. A partir de estos datos, calcula la masa atómica del estroncio en estado natural.
M.a.= (83.913 x 0.0056) + (85.909 x 0.0986) + (86.909 x 0.0702) + (87.906 x 0.8256) = 87.6167 uma.
5. El Uranio tiene 3 isótopos: 234 uma a 0.0057%, 235 uma a 0.72% y 238 uma a 99.27%. calcula la masa atómica.
M.a.= (234 x 0.000057) + (235 x 0.0072) + (238 x 0.9927) = 237.9679 uma
6. El oxígeno tiene 3 isótopos: (99.759%) con masa atómica 15.99491 umas, (0.037%) con un masa atómica de 16.99914 umas y (0.204%) con una masa de 17.99916. ¿Cuál es la masa atómica del oxígeno?
M.a.= (15.99491 x .99759) + (16.99914 x 0.00037) + (17.99916 x 0.00204) = 15.9994
7. El cobre natural está formado por los isótopos Cu-63 y Cu-65. El más abundante es el primero, con una distribución isotópica de 64, 4 %. Calcula la masa atómica aproximada del cobre.
M.a.= (63 x 0.644) + (65 x 0.356) = 63.7120
8. El plomo tiene 4 isótopos: Pb-204, Pb-207, Pb-208 y Pb-209. La abundancia de los tres primeros es 2, 28.2 y 57.8 %. Calcula la masa atómica del Plomo.
M.a.= (204 x 0.02) + (207 x 0.282) + (208 x 0.578) + (209 x 0.12) = 207.7580
9. El litio tiene dos isótopos: 6.01512 uma a 7.42% y 7.016 uma a 92.58%, determina la masa atómica del litio.
M.a= (6.01512 x 0.0742) + (7.016 x 0.9258) = 6.9417
10. El Estaño tiene 10 isótopos: 112 uma a 0.95%, 114 uma a 0.65%, 115 uma a 0.34%, 116 uma a 14.24%, 117 uma a 7.57%, 118 uma a 24.01%, 119 uma a 8.58%, 120 uma a 32.97%, 122 uma a 4.71% y 124 uma a 5.98%. Calcula la masa atómica del Estaño.
M.a.= (112 x 0.0095) + (114 x 0.0065) + (115 x 0.0034) + (116 x 0.1424) + (117 x 0.0757) + (118 x 0.2401) + (119 x 0.0858) + (120 x 0.3297) + (122 x 0.0471) + (124 x 0.0598) = 118.8387
Mol.
Definición.
Es la unidad con que se mide la
cantidad de materia.
Problemas de concentración.
¿Cuál
será la molaridad de una solución que contiene 64 gr de Metanol (p.m 32 gr/mol)
en 500 ml de solución?
Metanol = 64 gr.
p.m. = 32 gr / mol.
500 ml solución = 0.5 litros
M= 64 gr / 32 gr / mol / 0.5 L =
4 Molar.
Calcule
la molaridad de una solución que contiene 32g de cloruro de sodio en 0.75L de solución.
Moles Soluto = gramos soluto/
masa molar soluto
Moles NaCl = 32g NaCl / 58.4g
NaCl = 0.55 mol NaCl
M NaCl = 0.55 mol NaCl / 0.75 L
solución = 0.73 Molar.
Reacción de óxido-reducción (REDOX).
Definición.
Es toda reacción química en la
que uno o más electrones se transfieren entre los reactivos, provocando un
cambio en sus estados de oxidación.
¿Qué es un reductor y un oxidante?
Reductor. Es aquel que cede electrones en una reacción óxido-reducción.
Oxidante. Es aquel que gana electrones en una reacción óxido-reducción.
¿Cuándo una sustancia se oxida o se reduce?
Una sustancia se oxida cuando
pierde o cede electrones, y se reduce cuando los acepta o gana.
Balanceo de ecuaciones REDOX
martes, 26 de agosto de 2014
Número de oxidación. Reglas para calcularlo.
Regla 1. Todo átomo sin combinación su N.O. es cero.
Ejemplo 1. ¿Cuál es el número de oxidación del gas cloro (Cl2)?
R=0
Ejemplo 2. ¿Cuál es el número oxidación del sodio (Na)?
R=0
Ejemplo 3. ¿Cuál es el número de oxidación del ozono (O3)?
R=0
Regla 2. Como regla general, para el hidrógeno y el oxígeno, H= +1
y O= -2.
Cuando el oxígeno forma peróxidos
(se combina con algún metal), O = –1
Cuando el oxígeno se combina con
el flúor, O= +2
Ejemplo 3. ¿Cuál es el número de oxidación del oxígeno en el
siguiente compuesto?
CO ----> O= -2
Ejemplo 4. ¿Cuál es el número de oxidación del oxígeno en el
siguiente peróxido?
Li2O2 ---->
O= -1
Ejemplo 5. ¿Cuál es el número de oxidación del oxígeno en el
siguiente compuesto?
F2O ----> O=+2
Ejemplo 6. ¿Cuál es el número de oxidación del hidrógeno y oxígeno
cuando forman agua?
H2O ----> H=
+1 O= -2
Regla 3. Los elementos del grupo IA tienen estado de oxidación +1, Los
elementos del grupo IIA tienen estado de oxidación +2
Ejemplo 7. ¿Cuál es el número de oxidación del Potasio (K) en el
siguiente compuesto?
KNO3 ----> K= +1
Ejemplo 8. ¿Cuál es el número de oxidación del Sodio (Na) en el
siguiente compuesto?
NaCl ----> Na= +1
Regla 4. El número de oxidación de toda molécula simple o compuesta
es cero, por ejemplo:
Ejemplo 9. Sea el compuesto Fe2O3, calcular
el número de oxidación del Fe.
Fe2O3 ---->
No conocemos el N.O. de Fe, por lo que será X, como Fe tiene un subíndice 2,
será 2x. el N.O. de O es -2, como tiene un subíndice 3, entonces será -6.
2x + 3(-2) = 0
2x – 6 = 0
2x = 0 + 6
x = 6 / 2
x = 3 El N.O de Fe es +3
Ejemplo 10. Calcular el número de oxidación del hierro, cuando
forma el siguiente peróxido: Fe2O4
2x + 4(-2) = 0
2x – 8 = 0
2x = 0 + 8
x = 8 / 2
x = 4 El N.O de Fe es +4
Consulta todas nuestras tareas en nuestro sitio Web: http://grupo-rios.webnode.mx/tareas-y-punto/
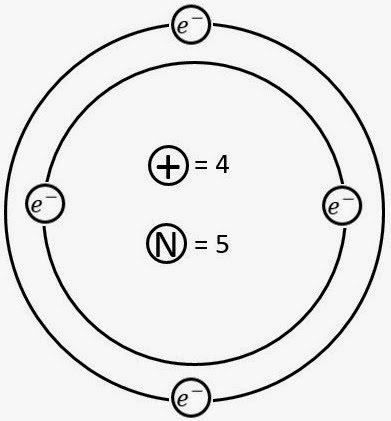
Ejercicios del Modelo de Bohr.
Para representar el átomo de cualquier elemento a través del Modelo de Bohr, debes seguir estos pasos:
2. El NA representa el número de protones (P) y electrones (E) del átomo.
3. Para determinar el número de neutrones (N), debemos restar del número entero de la MA el NA.
4. Las órbitas se nombran a partir de la letra K, por lo que la primera se llama así, la segunda se llama L y así sucesivamente, el número de electrones de cada nivel son:
K = 2
L = 8
M = 18
N = 32
O = 50
P = 32
Q = 18
5. Distribuir los electrones llenando las órbitas en orden alfabético.
Con esto concluyes tu modelo de Bohr.
Ejemplos:
1. Be.
NA=4
MA=9.01
P=4
E=4
N=9-4=5
1.Identificar en la Tabla Periódica el elemento, para determinar el número atómico (NA) y la masa atómica (MA).
3. Para determinar el número de neutrones (N), debemos restar del número entero de la MA el NA.
4. Las órbitas se nombran a partir de la letra K, por lo que la primera se llama así, la segunda se llama L y así sucesivamente, el número de electrones de cada nivel son:
K = 2
L = 8
M = 18
N = 32
O = 50
P = 32
Q = 18
5. Distribuir los electrones llenando las órbitas en orden alfabético.
Con esto concluyes tu modelo de Bohr.
Ejemplos:
1. Be.
NA=4
MA=9.01
P=4
E=4
N=9-4=5
2. Ne
NA=10
MA=20.18
P=10
E=10
N=20-10=10
3. Ar
NA=18
MA=39.95
P=18
E=18
N=40-18=22
4. Kr
NA=36
MA=83.80
P=36
E=36
N=84-36=48
5. Na
NA=11
MA=22.99
P=11
E=11
N=23-11=12
domingo, 24 de agosto de 2014
Partículas que constituyen al átomo.
Neutrones: Partículas con carga neutra, que se encuentra en el núcleo del átomo. Fue descubierto por James Chadwick en el año de 1932.
Protones: Partículas con carga eléctricamente positiva, que se encuentra en el núcleo del átomo. Fu descubierto por Ernest Rutherford en el año 1918.
Electrones: Partículas con carga eléctricamente negativa, que se encuentra describiendo órbitas alrededor del núcleo. Fue descubierto por Joseph John Thomson en 1897.
Modelos atómicos.
- Demócrito. Defiende que toda la materia no es más que una mezcla de elementos originarios que poseen las características de inmutabilidad y eternidad, concebidos como entidades infinitamente pequeñas y, por tanto, imperceptibles para los sentidos, a las que Demócrito llamó átomos, término griego que significa tanto "que no puede cortarse" como "indivisible".
- Dalton. El modelo permitió aclarar por primera vez por qué las sustancias químicas reaccionaban en proporciones estequiométricas fijas (Ley de las proporciones constantes), y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros (Ley de las proporciones múltiples). Además el modelo aclaraba que aun existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos. En esencia, el modelo explicaba la mayor parte de la química de fines del siglo XVIII y principios del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple.
- Thomson. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, como un pudin de pasas. Postulaba que los electrones se distribuían uniformemente en el interior del átomo, suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad.
- Rutherford. Fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo" muy pequeño; que concentra toda la carga eléctrica positiva y casi toda la masa del átomo. Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.
- Bohr. Es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados. Fue propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905.
Ácidos y bases.
Características.
- Ácidos. Es cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura. Tienen sabor agrio (limón, vinagre, etc). En disolución acuosa enrojecen la tintura o papel de tornasol Decoloran la fenolftaleína enrojecida por las bases Producen efervescencia con el carbonato de calcio (mármol). Reaccionan con algunos metales (como el cinc, hierro,…), desprendiendo hidrógeno. Neutralizan la acción de las bases. En disolución acuosa dejan pasar la corriente eléctrica, experimentando ellos, al mismo tiempo una descomposición química. Concentrados destruyen los tejidos biológicos vivos (son corrosivos para la piel). Enrojecen ciertos colorantes vegetales. Disuelven sustancias. Pierden sus propiedades al reaccionar con bases.
- Bases. Es cualquier sustancia que presente propiedades alcalinas. Tiene sabor cáustico o amargo (a lejía). En disolución acuosa azulean el papel o tintura de tornasol. Enrojecen la disolución alcohólica de la fenolftaleína. Producen una sensación untuosa al tacto. Precipitan sustancias disueltas por ácidos. Neutralizan la acción de los ácidos. En disolución acuosa dejan pasar la corriente eléctrica, experimentando ellas, al mismo tiempo, una descomposición química. Suaves al tacto pero corrosivos con la piel (destruyen los tejidos vivos). Dan color azul a ciertos colorantes vegetales. Disuelven grasas y el azufre. Pierden sus propiedades al reaccionar con ácidos. Se usan en la fabricación de jabones a partir de grasas y aceites
Valor de pH.
- Ácidos. Menor que 7.
- Bases. Mayor que 7 hasta 14.
¿Qué es una reacción de neutralización y que compuestos se forman durante la misma?
Es una reacción entre un ácido y una base, generalmente en las reacciones acuosas ácido-base se forma agua y una sal
Ejemplos:
- Ácidos. Ácido Nítrico HNO3, Ácido Clorhídrico HCL, Ácido Fosfórico H3PO3, Ácido Cítrico C6H8O7, Ácido Sulfúrico H2SO4, Ácido Bórico H3BO3, Ácido Acetil Salicílico C8H6O4, Ácido Acético C2H4O2, Ácido Láctico C3H6O3, Ácido Benzoico C6H5-COOH.
- Bases. Hidróxido de Sodio NaOH, Hidróxido de Potasio KOH, Hidróxido de Aluminio Al(OH)3, Amoniaco NH3, Hidróxido de Amonio NH4(OH), Hidróxido de Calcio Ca(OH)2, Hidróxido de Litio LiOH, Amiduro de Sodio NaNH2, Hidruro de Sodio HNa, Hidróxido de Cromo Cr(OH3).
Enlaces químicos.
Tipos de enlace.
- Iónico. El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario.
- Covalente. Lo característico del enlace covalente es la formación de pares electrónicos compartidos, independientemente de su número.
- Metálico. En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos.
Características.
- Enlace iónico.
- Ruptura de núcleo masivo.
- Sus enlaces son muy fuertes.
- Son sólidos a temperatura ambiente y poseen una estructura cristalina en el sistema cúbico.
- Altos puntos de fusión (entre 300 °C y 1000 °C) y ebullición.
- Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
- Son solubles en agua y otras disoluciones acuosas debido al dipolo eléctrico que presentan las moléculas de agua; capaces de destruir la red.
- Una vez en solución acuosa son excelentes conductores de electricidad, ya que entonces los iones quedan libres.
- En estado sólido no conducen la electricidad, ya que los iones ocupan posiciones muy fijas en la red. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla del circuito se encenderá. Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello éste funciona.
- Enlace covalente.
- Enlace sencillo o simple: se comparten 2 electrones de la capa de valencia.
- Enlace doble: se comparten cuatro electrones, en dos pares, de la capa de valencia.
- Enlace triple: se comparten 6 electrones de la capa de valencia en 3 pares.
- Enlace cuádruple: es la unión de 8 electrones de la capa de valencia en 4 pares.
- Enlace quíntuple: es la unión de 10 electrones de la capa de valencia en 5 pares.
- Enlace metálico.
- Alta conductividad térmica y eléctrica, los electrones pueden moverse con libertad por la nube electrónica.
- Son dúctiles (factibles de hilar) y maleables (factibles de hacer láminas), su deformación no implica una rotura de enlaces ni una aproximación de iones de igual carga, como ocurría en los compuestos iónicos por ejemplo.
- Los puntos de fusión son moderadamente altos, la estabilidad de la red positiva circundada por la nube de electrones es alta.
- Son difícilmente solubles en cualquier disolvente, por el mismo motivo que justifica el punto anterior. (Pensar en la forma de "atacar"el agua a un compuesto iónico, en un metal que es "un todo uniforme" no existe esa posibilidad.
Ejemplos.
- Enlace iónico. Cloruro de Sodio (NaCl), Cloruro de Potasio (KCl), Ioduro de Potasio (KI), Oxido de Hierro (FeO), Cloruro de Plata (AgCl), Oxido de Calcio (CaO), Bromuro de Potasio (KBr), Óxido de Zinc (ZnO), Oxido de Berilio (BeO), Cloruro de Cobre (CuCl2).
- Enlace covalente. Molécula de cloro (Cl2), Molécula de Agua (H2O), Metano (CH4), Molécula de Oxígeno (O2), Molécula de Hidrógeno (H2), Molécula de Flúor (F2), Amoniaco (NH3), Trióxido de Azufre (SO3), Bióxido de Carbono (CO2), Cloruro de Fósforo (PCl5).
- Enlace metálico. Oro (Au), Alpaca (Zn, Cu, Ni), Latón (Cu, Zn), Hierro (Fe), Aluminio (Al), Cobre (Cu), Estaño (Sn), Plata (Ag), Níquel (Ni), Zinc (Zn).
Tipos de sustancias.
Definición.
- Elementos. Son sustancias básicas que no se pueden separar en sustancias más simples por los métodos químicos comunes, se representan con símbolos relacionados con su nombre. En algunos casos solo se utiliza la primera letra en mayúscula y en otros una mayúscula seguida de una letra minúscula.
- Compuestos. Son elementos que se encuentran unidos entre si formando un tipo de sustancias más complejas, sus propiedades físicas y químicas de son muy diferentes a las de los elementos que les dan origen. Los compuestos se representan con fórmulas que incluyen el símbolo del elemento y a la derecha un subíndice que indica la cantidad de átomos de ese elemento que forma el compuesto. Pueden separarse por métodos físicos.
- Mezclas. Es la unión de dos o más sustancias, se clasifican en homogéneas y heterogéneas.
- Homogénea. No se distingue a simple vista que la mezcla está formada por dos o más sustancias. Su apariencia es uniforme. También se conocen como disoluciones.
- Heterogénea. Se distingue a simple vista que la mezcla está formada por dos o más sustancias.
Ejemplos.
- Elementos. El hierro (Fe), el oro (Au), el aluminio (Al), el oxígeno (O), el mercurio (Hg).
- Compuestos. El agua (H2O), el amoniaco (NH3), el dióxido de carbono (CO2), la sal de cocina o cloruro de sodio (NaCl) y el bicarbonato de sodio (NaHCO3).
- Mezclas.
- Homogénea. El aire, el gas doméstico, los perfumes, la gasolina, el agua potable.
- Heterogénea. Las ensaladas, la granola, aceite y agua, agua y arena, vinagre y aceite.
Métodos de separación de las mezclas.
- Métodos físicos. Se dan de manera natural. Ejemplos: Sedimentación.
- Métodos mecánicos. No destruyen las sustancias originales. Ejemplos: Decantación, filtración, evaporación, destilación, extracción, sublimación, centrifugación, cristalización, cromatografía, decantación, tamizado.
- Métodos químicos. Destruyen las sustancias originales. Ejemplos: Electrólisis, gravimetrías, descomposición química.
Estados de agregación de la materia.
Características:
- Sólidos. Cohesión elevada, tienen una forma definida y memoria de forma, son incompresibles, resistencia a la fragmentación, fluidez muy baja o nula y algunos de ellos se subliman.
- Líquidos. Cohesión menor, movimiento energía cinética, son fluidos (no poseen forma definida, ni memoria de forma por lo que toman la forma de la superficie o el recipiente que lo contiene), en el frío se contraen (exceptuando el agua), posee fluidez a través de pequeños orificios, puede presentar difusión y son poco compresibles.
- Gases. Cohesión casi nula, no tienen forma definida y su volumen es variable.
¿Cómo se distribuyen las moléculas en cada estado de agregación?
- Sólidos. Sus moléculas están fijas, la distribución espacial es ordenada.
- Líquidos. Sus moléculas están separadas por una distancia de la misma magnitud que el diámetro molecular, la distribución espacial de las moléculas es más aleatoria que los sólidos, pero menos aleatoria que los gases.
- Gases. Existe movimiento caótico de las moléculas, que están separadas unas de otras por distancias muy grandes comparadas con su diámetro.
Cambios de estado.
- Sublimación. Paso de sólido a gas sin pasar por el estado líquido.
- Sublimación inversa o deposición. Paso de gas a sólido sin pasar por el estado líquido.
- Fusión. Paso de solido a líquido.
- Vaporización. Paso de líquido a gas.
- Condensación. Paso de gas a líquido.
- Solidificación. Paso de líquido a sólido.
Propiedades de la Materia.
Intensivas. Son aquellas que no dependen de la cantidad de sustancia o del tamaño de un cuerpo, por lo que el valor permanece inalterable al subdividir el sistema inicial en varios subsistemas, por este motivo no son propiedades aditivas.
Ejemplos: la temperatura, la velocidad, el punto de ebullición, el punto de fusión, una magnitud escalar, una magnitud vectorial, la solubilidad, la viscosidad, la concentración,
Extensivas. Son aquellas que sí dependen de la cantidad de sustancia o del tamaño de un cuerpo, son magnitudes cuyo valor es proporcional al tamaño del sistema que describe.
Ejemplos: la masa, el volumen, el peso, cantidad de sustancia, resistencia eléctrica, densidad de la masa, velocidad de la masa.
Etiquetas:
Materia,
Propiedades,
Propiedades de la materia,
Propiedades extensivas de la materia.,
Propiedades intensivas de la materia,
Química
Suscribirse a:
Entradas (Atom)